Creado por: Martínez Vásquez Bryan Andrés
Grado: 11-3T
Alcohol
Propiedades generales o físicas:
Los alcoholes suelen ser líquidos incoloros de olor característico, solubles en el agua en proporción variable y menos densos que ella. Al aumentar la masa molecular, aumentan sus puntos de fusión y ebullición, pudiendo ser sólidos a temperatura ambiente (p.e. el pentaerititrol funde a 260 °C). A diferencia de los alcanos de los que derivan, el grupo funcional hidroxilo permite que la molécula sea soluble en agua debido a la similitud del grupo hidroxilo con la molécula de agua y le permite formar enlaces de hidrógeno. La solubilidad de la molécula depende del tamaño y forma de la cadena alquílica, ya que a medida que la cadena alquílica sea más larga y más voluminosa, la molécula tenderá a parecerse más a un hidrocarburo y menos a la molécula de agua, por lo que su solubilidad será mayor en disolventes apolares, y menor en disolventes polares. Algunos alcoholes (principalmente polihidroxílicos y con anillos aromáticos) tienen una densidad mayor que la del agua.
El hecho de que el grupo hidroxilo pueda formar enlaces de hidrógeno también afecta a los puntos de fusión y ebullición de los alcoholes. A pesar de que el enlace de hidrógeno que se forma sea muy débil en comparación con otros tipos de enlaces, se forman en gran número entre las moléculas, configurando una red colectiva que dificulta que las moléculas puedan escapar del estado en el que se encuentren (sólido o líquido), aumentando así sus puntos de fusión y ebullición en comparación con sus alcanos correspondientes. Además, ambos puntos suelen estar muy separados, por lo que se emplean frecuentemente como componentes de mezclas anticongelantes. Por ejemplo, el 1,2-etanodiol tiene un punto de fusión de -16 °C y un punto de ebullición de 197 °C.
Propiedades químicas de los alcoholes
Los alcoholes pueden comportarse como ácidos o bases gracias a que el grupo funcional es similar al agua, por lo que se establece un dipolo muy parecido al que presenta la molécula de agua.
Por un lado, si se enfrenta un alcohol con una base fuerte o con un hidruro de metal alcalino se forma el grupo alcoxi, en donde el grupo hidroxilo se desprotona dejando al oxígeno con carga negativa. La acidez del grupo hidroxilo es similar a la del agua, aunque depende fundamentalmente del impedimento estérico y del efecto inductivo. Si un hidroxilo se encuentra enlazado a uncarbono terciario, éste será menos ácido que si se encontrase enlazado a un carbono secundario, y a su vez éste sería menos ácido que si estuviese enlazado a un carbono primario, ya que el impedimento estérico impide que la molécula se solvate de manera efectiva. El efecto inductivo aumenta la acidez del alcohol si la molécula posee un gran número de átomos electronegativos unidos a carbonos adyacentes (los átomos electronegativos ayudan a estabilizar la carga negativa del oxígeno por atracción electrostática).
Por otro lado, el oxígeno posee 2 pares electrónicos no compartidos por lo que el hidroxilo podría protonarse, aunque en la práctica esto conduce a una base muy débil, por lo que para que este proceso ocurra, es necesario enfrentar al alcohol con un ácido muy fuerte.
Gráficas alusivas a los alcoholes
Usos de los alcoholes
Los alcoholes se utilizan como productos químicos intermedios y
disolventes en las industrias de textiles, colorantes, productos
químicos, detergentes, perfumes, alimentos, bebidas, cosméticos,
pinturas y barnices. Algunos compuestos se utilizan también en la
desnaturalización del alcohol, en productos de limpieza, aceites
y tintas de secado rápido, anticongelantes, agentes espumígenos
y en la flotación de minerales.
Existen muchos mas usos de los alcoholes y sus derivados aquí están algunos de ellos:
El n-propanol es un disolvente utilizado en lacas, cosméticos,
lociones dentales, tintas de impresión, lentes de contacto y
líquidos de frenos. También sirve como antiséptico, aromatizante
sintético de bebidas no alcohólicas y alimentos, producto químico
intermedio y desinfectante
El n-butanol se emplea como disolvente de pinturas, lacas,
barnices, resinas naturales y sintéticas, gomas, aceites vegetales,
tintes y alcaloides. Se utiliza como sustancia intermedia en la
fabricación de productos químicos y farmacéuticos, y en las
industrias de cuero artificial, textiles, gafas de seguridad, pastas
de caucho, barnices de laca, impermeables, películas fotográficas
y perfumes.
El isobutanol , un disolvente para revestimientos de superficie y
adhesivos, se emplea en lacas, decapantes de pinturas, perfumes,
productos de limpieza y líquidos hidráulicos.
El etanol es la materia prima de numerosos productos, como
acetaldehído, éter etílico y cloroetano. Se utiliza como anticongelante, aditivo alimentario y medio de crecimiento de levaduras,
en la fabricación de revestimientos de superficie y en la preparación de mezclas de gasolina y alcohol etílico. La producción de
butadieno a partir de alcohol etílico ha tenido una gran importancia en las industrias de los plásticos y el caucho sintético.
El alcohol etílico puede disolver muchas sustancias y, por este
motivo, se utiliza como disolvente en la fabricación de fármacos,
plásticos, lacas, barnices, plastificantes, perfumes, cosméticos,
aceleradores del caucho, etc
El pentanol se utiliza en la fabricación de lacas, pinturas,
barnices, decapantes, caucho, plásticos, explosivos, líquidos
hidráulicos, pegamentos para calzado, perfumes, productos
químicos y farmacéuticos, y en la extracción de grasas. Cuando
se utilizan como disolventes, sirven perfectamente las mezclas de
alcoholes, pero para síntesis químicas o extracciones más selectivas se requieren a menudo productos más puros.
Beneficios y riesgos para la salud
Riesgos:
El alcohol metílico tiene propiedades tóxicas que pueden
hacerse evidentes tanto por exposición aguda como crónica. Los
alcohólicos que ingieren este líquido o los trabajadores que
inhalan sus vapores pueden sufrir lesiones. En experimentos con
animales se ha demostrado que el alcohol metílico puede penetrar en la piel en cantidad suficiente como para causar una intoxicación mortal.
En casos de intoxicación grave, generalmente por ingestión, el
alcohol metílico actúa de forma específica en el nervio óptico,causando ceguera como resultado de la degeneración del nervio
óptico, acompañada de cambios degenerativos en las células
ganglionares de la retina y trastornos circulatorios en la coroides.
La ambliopía es normalmente bilateral y puede aparecer pocas
horas después de la ingestión, mientras que la ceguera total no se
instaura hasta pasada una semana. Las pupilas aparecen dilatadas, la esclerótica congestionada y el iris está pálido y presenta
escotoma central; las funciones respiratorias y cardiovasculares
están deprimidas y, en los casos muy graves, el paciente está
inconsciente, si bien el coma puede ir precedido de delirio.
Las consecuencias de la exposición industrial a los vapores de
alcohol metílico pueden variar considerablemente de un trabajador a otro. Bajo diferentes condiciones de intensidad y duración
de la exposición, los síntomas de la intoxicación son: irritación
de las mucosas, cefalea, zumbido de oídos, vértigo, insomnio,
nistagmo, dilatación de las pupilas, visión borrosa, náuseas,
vómitos, cólicos y estreñimiento. Pueden producirse lesiones cutá-
neas por la acción irritante y disolvente del alcohol metílico y
también por la acción lesiva de los tintes y resinas disueltas en él.
Estas lesiones se localizan preferentemente en las manos, las
muñecas y los antebrazos. No obstante, la causa de estos efectos
perjudiciales se debe en general a exposiciones prolongadas a
concentraciones muy superiores a los límites recomendados por
las autoridades para prevenir la intoxicación por inhalación de
vapores de alcohol metílico.
Beneficios:
Previene enfermedades del corazón: Se dice que los antioxidantes en el vino tinto ayudan a la salud del corazón y el sistema cardiovascular. Las personas activas, que consumen por lo menos una bebida alcohólica a la semana, tienen un 50% menos de probabilidades de desarrollar una enfermedad cardíaca que una persona que se pasa todo el día frente al televisor.
Aumenta el colesterol 'bueno': La cerveza y el vino pueden aumentar el nivel de lipoproteínas de alta densidad (HDL, en inglés) que son capaces de retirar el colesterol de las arterias y transportarlo de vuelta al hígado para su excreción, lo que ayuda a evitar enfermedades como la arteriosclerosis. Sin embargo, hay que tener cuidado con las calorías de la cerveza, especialmente las de las oscuras; el abdomen podría sufrir las consecuencias.
Reduce la artritis: El alcohol puede disminuir considerablemente las posibilidades de contraer artritis en la vejez. Sin embargo, su consumo excesivo pude aumentar el riesgo de desarrollar la osteoporosis. Así, mientras una copa de vino puede evitar el dolor persistente de los huesos, también puede volverlos más propensos a romperse como ramitas. La solución: un 'ruso blanco', un cóctel de vodka con leche, que podría ayudar a los huesos de las dos maneras.
Aumenta la fibra: Al derivar de granos, la cerveza es realmente una fuente de buena fibra dietética, buena para aliviar algunos problemas de estreñimiento, hemorroides, diverticulosis y síndrome de intestino (colon) irritable. De hecho, medio litro (unas dos tazas) de cerveza puede proporcionar más de un cuarto de su ingesta diaria necesaria de fibra. Pero tenga cuidado, demasiada fibra puede conducir a visitar el inodoro más veces de lo debido.
Previene ciertos tipos de cáncer: Así es, incluso una amenaza de recaída y muerte por ciertos tipos de cáncer se puede reducir con unos pocos pero generosos tragos de vino. Para ser específicos, la enfermedad de Hodgking y el cáncer de riñón podrán ser combatidos, incluso se podrán prevenir, con un poco de vino tinto.
Previene enfermedades neurológicas: Según algunos estudios, tomar un poco de alcohol de vez en cuando puede ayudar a prevenir el mal de Alzheimer y accidentes cerebrovasculares. Las proteínas de las vainas de mielina, que ayudan a proteger las vías neurológicas en el sistema nervioso, responden positivamente al alcohol. Por supuesto, el exceso provoca la muerte de las células del cerebro, por lo que una vez más, la moderación es la clave.
Salva vidas: Así es, pero de una manera muy particular. En caso de que, por alguna razón, llegara a ingerir anticongelante, una maratón de tragos de vodka o whisky puede salvarle la vida. ¡Es verdad! El alcohol actúa anulando los efectos peligrosos del etilenglicol, el componente principal en los anticongelantes.
Estructuralmente los éteres pueden considerarse derivados del agua o alcoholes, en los que se han reemplazado uno o dos hidrógenos, respectivamente, por restos carbonados.
La estructura angular de los éteres se explica bien asumiendo una hibridación sp3 en el oxígeno, que posee dos pares de electrones no compartidos,no puede establecer enlaces de hidrógeno consigo mismo y sus puntos de ebullición y fusión son muchos más bajos que los alcoholes referibles.
Sus puntos de ebullición son menores que los alcoholes que lo formaron pero son similares a los alcanos de pesos moleculares semejantes. A diferencia de los alcoholes no establecen uniones puente de hidrógeno y esto hace que sus puntos de ebullición sean significativamente menores.
Son algo solubles en agua. Son incoloros y al igual que los ésteres tienen olores agradables. El más pequeño es gaseoso, los siguientes líquidos y los más pesados sólidos.
Propiedades Químicas:
No tienen hidrógenos activos como en los casos de los alcoholes o ácidos. Por este motivo son inertes ante metales como el sodio o potasio o litio. Necesitan del calor para descomponerse y ahí si poder reaccionar con algunos metales.
Los éteres tienen muy poca reactividad química, debido a la dificultad que presenta la ruptura del enlace
C—O. Por ello, se utilizan mucho como disolventes inertes en reacciones orgánicas.
En contacto con el aire sufren una lenta oxidación en la que se forman peróxidos muy inestables y poco volátiles. Estos constituyen un peligro cuando se destila un éter, pues se concentran en el residuo y pueden dar lugar a explosiones. Esto se evita guardando el éter con hilo de sodio o añadiendo una pequeña cantidad de un reductor (SO4Fe, LiAIH4) antes de la destilación.
Los éteres no son reactivos a excepción de los epóxidos. Las reacciones de los epóxidos pasan por la apertura del ciclo. Dicha apertura puede ser catalizada por ácido o apertura mediante nucleófilo.
Gráficas alusivas a los éteres:
Usos de los éteres:
Medio para extractar para concentrar ácido acético y otros ácidos.
Medio de arrastre para la deshidratación de alcoholes etílicos e isopropílicos.
Disolvente de sustancias orgánicas (aceites, grasas, resinas, nitrocelulosa, perfumes y alcaloides).
Combustible inicial de motores Diésel.
Fuertes pegamentos
Antinflamatorio abdominal para después del parto, exclusivamente uso externo.
Desinflamatorio abdominal para despues del parto, exclusivamente uso externo.
Es llamado la medicina antigua porque en la antiguedad se usaba como anestesico, debido a que no existian los metodos de anestesia moderna.
Beneficios y riesgos para la salud
Riesgos:
El éter dietilico puede afectarle al inhalarlo
el contacto puede irritar la piel y los ojos
respirarlo puede generar irritación en la nariz y la garganta
respirar éter dietilico puede generar somnolencia, excitación, mareos, vómitos, respiración irregular y aumento de la salivación.
La alta exposición puede generar perdida del conocimiento, daños al riñón e incluso la muerte
el contacto prolongado con la piel puede secarla y agrietarla.
Beneficios:
El éter es conocido porque se puede usar como un relajante o calmante pero no es viable para usarse en humanos porque son mas los riesgos que los beneficios que se obtienen de él.
Compuestos mas representativos de los éteres
Bibliografia:
Imagenes
https://www.google.com.co/search?q=eteres&rlz=1C1SAVG_enCO540CO540&um=1&ie=UTF-8&hl=es&tbm=isch&source=og&sa=N&tab=wi&ei=m4nsUdvBJY729gTYkoDQBw&biw=1366&bih=667&sei=nYnsUaPKGvKv4APauIGABA#facrc=_&imgdii=_&imgrc=Uz3ZXXFn0kAoRM%3A%3BqHMljp93HeMOaM%3Bhttp%253A%252F%252Fhtml.rincondelvago.com%252F0000383811.png%3Bhttp%253A%252F%252Fhtml.rincondelvago.com%252Fformulacion-y-nomenclatura-organica.html%3B1605%3B525
https://www.google.com.co/search?q=eteres&rlz=1C1SAVG_enCO540CO540&um=1&ie=UTF-8&hl=es&tbm=isch&source=og&sa=N&tab=wi&ei=m4nsUdvBJY729gTYkoDQBw&biw=1366&bih=667&sei=nYnsUaPKGvKv4APauIGABA#facrc=_&imgdii=_&imgrc=b05gc85hVbqV5M%3A%3BVFDZSCqRHJi6EM%3Bhttp%253A%252F%252Fwww.100ciaquimica.net%252Fimages%252Ffororg%252Fima%252Feter3.gif%3Bhttp%253A%252F%252Fwww.100ciaquimica.net%252Ffororg%252Feteres.htm%3B536%3B294
https://www.google.com.co/search?q=eteres&rlz=1C1SAVG_enCO540CO540&um=1&ie=UTF-8&hl=es&tbm=isch&source=og&sa=N&tab=wi&ei=m4nsUdvBJY729gTYkoDQBw&biw=1366&bih=667&sei=nYnsUaPKGvKv4APauIGABA#facrc=_&imgdii=_&imgrc=FbiY1H3SUTqghM%3A%3B-nqmnOo0NsqBGM%3Bhttp%253A%252F%252Fqorganica.perruchos.com%252Fsites%252Fdefault%252Ffiles%252Fimages%252Feteres-03.jpg%3Bhttp%253A%252F%252Fqorganica.perruchos.com%252Fbook%252Fexport%252Fhtml%252F222%3B589%3B305
https://www.google.com.co/search?q=compuestos+mas+representativos+de+los+eteres&rlz=1C1SAVG_enCO540CO540&um=1&ie=UTF-8&hl=es&tbm=isch&source=og&sa=N&tab=wi&ei=QZbsUcigJoqE9gTMwIGYDg&biw=1366&bih=667&sei=RZbsUY3_O6rj4APmhIDABg#um=1&rlz=1C1SAVG_enCO540CO540&hl=es&tbm=isch&sa=1&q=compuestos+de+eteres&oq=compuestos+de+eteres&gs_l=img.3..0i24.252834.258194.0.258305.25.18.1.6.6.0.324.2542.2j14j0j2.18.0....0.0..1c.1.20.img.o9-632bTwbE&bav=on.2,or.r_cp.r_qf.&bvm=bv.49478099%2Cd.dmg%2Cpv.xjs.s.en_US.c75bKy5EQ0A.O&fp=ef7159679eeaa90f&biw=1366&bih=667&facrc=_&imgdii=_&imgrc=R2CxCdxw1Qn-EM%3A%3BVFDZSCqRHJi6EM%3Bhttp%253A%252F%252Fwww.100ciaquimica.net%252Fimages%252Ffororg%252Fima%252Feter2.gif%3Bhttp%253A%252F%252Fwww.100ciaquimica.net%252Ffororg%252Feteres.htm%3B386%3B129
http://www.google.com.co/imgres?imgurl=&imgrefurl=http%3A%2F%2Fhtml.rincondelvago.com%2Fformulacion-y-nomenclatura-organica.html&h=0&w=0&sz=1&tbnid=Uz3ZXXFn0kAoRM&tbnh=128&tbnw=393&zoom=1&docid=qHMljp93HeMOaM&hl=es&ei=HZnsUZOFEYa-9QSd7YDoBQ&ved=0CAEQsCU
Información sobre el trabajo
http://kira2629.wordpress.com/2009/06/20/propiedades-fisicas-y-quimicas-de-los-eteres/
http://es.wikipedia.org/wiki/%C3%89ter_(qu%C3%ADmica)
http://www2.udec.cl/matpel/sustanciaspdf/e/ETERDIETILICO.pdf
Ésteres
Propiedades generales o físicas:
Los ésteres pueden participar en los enlaces de hidrógeno como aceptadores, pero no pueden participar como donadores en este tipo de enlaces, a diferencia de los alcoholes de los que derivan.
Esta capacidad de participar en los enlaces de hidrógeno les convierte en más hidrosolubles que los hidrocarburos de los que derivan. Pero las ilimitaciones de sus enlaces de hidrógeno los hace más hidrofóbicos que los alcoholes o ácidos de los que derivan.
Esta falta de capacidad de actuar como donador de enlace de hidrógeno ocasiona el que no pueda formar enlaces de hidrógeno entre moléculas de ésteres, lo que los hace más volátiles que un ácido o alcohol de similar peso molecular.
Propiedades químicas:
En las reacciones de los ésteres, la cadena se rompe siempre en un enlace sencillo, ya sea entre el oxígeno y el alcohol o R, ya sea entre el oxígeno y el grupo R-CO-, eliminando así el alcohol o uno de sus derivados. La saponificación de los ésteres, llamada así por su analogía con la formación de jabones, es la reacción inversa a la esterificación.
Los ésteres se hidrogenan más fácilmente que los ácidos, empleándose generalmente el éster etílico tratado con una mezcla de sodio y alcohol (Reducción de Bouveault-Blanc). El hidruro de litio y aluminio reduce ésteres de ácidos carboxílicos para dar 2 equivalentes de alcohol. La reacción es de amplio espectro y se ha utilizado para reducir diversos ésteres. Las lactonas producen dioles.
Existen reacciones de condensación en las que se utiliza un reductor que aporte electrones para formar el enlace C-C entre grupos acilo, como el caso de la condensación aciloínica.
Gráficas alusivas a los ésteres:
Usos de los ésteres:
Muchos ésteres tienen un olor característico, lo que hace que se utilicen ampliamente como sabores y fragancias artificiales. Por ejemplo:
* metil butanoato: olor a piña
* metil salicilato (aceite de siempre verde): olor de las pomadas
* etil metanoato: olor a frambuesa
* pentil etanoato: olor a plátano
* pentil pentanoato: olor a manzana
* pentil butanoato: olor a pera o a albaricoque
* octil etanoato: olor a naranja.
Otros usos.
Disolventes
Los ésteres de bajo peso molecular son líquidos y se acostumbran a utilizar como disolventes, especialmente los acetatos de los alcoholes metílico, etílico y butílico.
Plastificantes
El acetatopropionato de celulosa y el acetatobutirato de celulosa han conseguido gran importancia como materiales termoplásticos. El nitrato de celulosa con un contenido de 10,5-11% de nitrógeno se llama piroxilina y con alcohol y alcanfor (plastificante) forma el celuloide. El algodón dinamita es nitrato de celulosa con el 12,5-13,5% de nitrógeno. La cordita y la balistita se fabrican a partir de éste, que se plastifica con trinitrato de glicerina (nitroglicerina). Los sulfatos de dimetilo y dietilo (ésteres del ácido sulfúrico) son excelentes agentes de alcoholización de moléculas orgánicas que contienen átomos de hidrógeno lébiles, como por ejemplo, el midón y la celulosa.
Aditivos Alimentarios
Estos mismos ésteres de bajo peso molecular que tienen olores característicos a fruta se utilizan como aditivos alimentarios, por ejemplo, en caramelos y otros alimentos que han de tener un sabor afrutado.
Productos Farmacéuticos
Productos de uso tan frecuente como los analgésicos se fabrican con ésteres.
Polímeros Diversos
Los ésteres de los ácidos no saturados, por ejemplo, del ácido acrílico o metacrílico, son inestables y se polimerizan rápidamente, produciendo resina; así, el metacrilato de metilo (lucita o plexiglás). De manera análoga los ésteres de los alcoholes no saturados son inestables y reaccionan fácilmente con ellos mismos; así, el acetado de vinilo se polimeriza dando acetato de polivinilo. Las resinas de poliéster, conocidas como gliptales, resultan de la poliesterificación de la glicerina con anhídrido ftálico; el proceso puede controlarse de manera que se produzca una resina fusible o infusible. Cuando la poliesterificación se realiza en presencia de un ácido no saturado de cadena larga del tipo de los aceites secantes, la polimerización de éste por oxidación se superpone a la poliesterificación y se producen los esmaltes sintéticos, duros y resistentes a la intemperie, que son muy adecuados por el acabado de los automóviles. La poliesterificación del etilenglicol con el ácido tereftálico produce fibra de poliéster. Si se da forma de láminas a este material, constituye una excelente película fotográfica.
Repelentes de insectos
Todos los repelentes de insectos que podemos encontrar en el mercado contienen ésteres.
Beneficios y riesgos para la salud
Beneficios
Omega 3 ácido etil ésteres es el nombre dado a las grasas poliinsaturadas que son buenas para la salud. Estas grasas están obligadas a reducir los niveles de triglicéridos en el cuerpo, lo que controla los niveles de colesterol malo y prevención de enfermedades del corazón y paro cardíaco súbito.
Hay numerosos otros beneficios del consumo de ésteres de omega 3 ácido etílico en forma de cápsulas. Estas cápsulas son fabricadas mediante el uso de aceite de pescado, que es una de las fuentes más ricas y más saludables, particularmente DHA y EPA.
Los beneficios más notables del consumo de estos se observan en el contexto de la prevención de ciertas enfermedades como el cáncer y la enfermedad de Alzheimer. Además, también son buenos para la promoción de la salud general y salud mental particular. Ésteres de Omega 3 prevenir la depresión y la ansiedad y otros trastornos mentales relacionadas con la salud.
Los médicos han reconocido los beneficios de salud asociados con el consumo de cápsulas de aceite de pescado. Recomiendan estos suplementos a personas de todas las edades, especialmente las mujeres embarazadas, niños y ancianos.
Cápsulas son buenos para reducir la inflamación en todo el cuerpo. Dichas medidas pueden adoptarse en condiciones inflamatorias como artritis, cistitis y prostatitis. Normalmente de 3 a 4 porciones de un suplemento nutricional de omega 3 son recomendadas por los médicos. Sin embargo, si usted es deficiente, puede incrementar esta dosis.
Riesgos
Los estudios han mostrado daños en el hígado, riñones, pulmones y testículos. Por otra parte, un estudio japonés publicado en 2006 realizado con primates jóvenes no ha encontrado daños testiculares de ningún tipo.
El ministerio de salud ha tomado conocimiento de la posible existencia de riesgos para la salud de los niños menores de 3 años por el empleo de ésteres de ácido ftálico como plastificantes en la fabricación de mordillos y otros artículos de puericultura, así como de juguetes que puedan ser mordidos o chupados.
Que si bien se reconoce que existen diversas fuentes de exposición a los ésteres de ácido ftálico tales como el aire, el ambiente, el agua de bebida y los alimentos. ante la posibilidad de que tengan efectos adversos sobre la salud el comité científico sobre toxicidad ha recomendado la adopción de medidas precautorias de restricción en el uso de ésteres de ácido ftálico en mordillos y juguetes pasibles de ser mordidos, destinados a niños menores de 3 años.
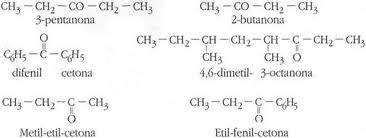
Compuestos mas representativos de los ésteres:
Bibliografia:
Imágenes:
http://www.google.com.co/imgres?imgurl=&imgrefurl=http%3A%2F%2Fwww.quimicaorganica.net%2Festeres-nomenclatura.html&h=0&w=0&sz=1&tbnid=VM_Rb8Ec68KufM&tbnh=183&tbnw=275&zoom=1&docid=FHHufdK5jSakkM&hl=es&ei=sp7sUdH1M47s9AT7k4CgCw&ved=0CAEQsCU
https://www.google.com.co/search?q=esteres&rlz=1C1SAVG_enCO540CO540&um=1&ie=UTF-8&hl=es&tbm=isch&source=og&sa=N&tab=wi&ei=hpzsUbWWNon29gS2oYDgDg&biw=1366&bih=624&sei=h57sUdTrFpCg4AP8mIGgCg#facrc=_&imgdii=_&imgrc=sbJ1_r0obKcUwM%3A%3BHeFSXbR6yKEyZM%3Bhttp%253A%252F%252Fnomenclaturandoando.files.wordpress.com%252F2011%252F05%252Fnomenclatura-esteres-01.gif%3Bhttp%253A%252F%252Fnomenclaturandoando.wordpress.com%252Festeres%252F%3B584%3B96
https://www.google.com.co/search?q=esteres&rlz=1C1SAVG_enCO540CO540&um=1&ie=UTF-8&hl=es&tbm=isch&source=og&sa=N&tab=wi&ei=hpzsUbWWNon29gS2oYDgDg&biw=1366&bih=624&sei=h57sUdTrFpCg4AP8mIGgCg#um=1&rlz=1C1SAVG_enCO540CO540&hl=es&tbm=isch&q=nomenclatura%20de%20esteres&revid=182623016&ei=pJ7sUfKrJ5C68wSLm4DYCg&ved=0CAsQsSU&bav=on.2,or.r_cp.r_qf.&bvm=bv.49478099%2Cd.dmg%2Cpv.xjs.s.en_US.c75bKy5EQ0A.O&fp=ef7159679eeaa90f&biw=1366&bih=624&facrc=_&imgdii=_&imgrc=6jXpZ25KuBrUAM%3A%3BESqvMnAfXhuRHM%3Bhttp%253A%252F%252Fs2.static.brasilescola.com%252Fimg%252F2012%252F10%252Fnomes-usuais.jpg%3Bhttp%253A%252F%252Fwww.brasilescola.com%252Fquimica%252Fnomenclatura-dos-Esteres.htm%3B383%3B370
https://www.google.com.co/search?q=esteres&rlz=1C1SAVG_enCO540CO540&um=1&ie=UTF-8&hl=es&tbm=isch&source=og&sa=N&tab=wi&ei=hpzsUbWWNon29gS2oYDgDg&biw=1366&bih=624&sei=h57sUdTrFpCg4AP8mIGgCg#um=1&rlz=1C1SAVG_enCO540CO540&hl=es&tbm=isch&q=nomenclatura%20de%20esteres&revid=182623016&ei=pJ7sUfKrJ5C68wSLm4DYCg&ved=0CAsQsSU&bav=on.2,or.r_cp.r_qf.&bvm=bv.49478099%2Cd.dmg%2Cpv.xjs.s.en_US.c75bKy5EQ0A.O&fp=ef7159679eeaa90f&biw=1366&bih=624&facrc=_&imgdii=_&imgrc=Yr_5sb0QTtBpzM%3A%3BIn6P1luuAMP3xM%3Bhttp%253A%252F%252Fupload.wikimedia.org%252Fwikipedia%252Fcommons%252F8%252F8b%252F%2525C3%252589STERES_MONOCARBOX%2525C3%25258DLICOS.png%3Bhttp%253A%252F%252Fes.m.wikipedia.org%252Fwiki%252FArchivo%253A%2525C3%252589STERES_MONOCARBOX%2525C3%25258DLICOS.png%3B1007%3B477
Información sobre el trabajo












.jpg)




.jpg)





.png)
.png)
.png)





.jpg)











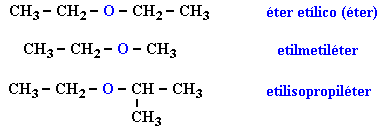



.gif)

